Desde o início da pandemia, temos a garantia de que o cumprimento do mascaramento da comunidade resolveria nossos problemas e impediria a propagação do SARS-CoV-2. No entanto, os dados de aplicativos do mundo real mostraram consistentemente que eles falham como uma medida de mitigação para proteção pessoal e, em vez de corrigir o curso da orientação aleatória que foi distribuída, fomos instruídos a máscara mais duro com aparatos cada vez mais restritivos, embora efetivamente não mitigadores.
BUT porque eles falharam e por que continuam falhando? Abaixo, detalhamos por que, mesmo assumindo uma hipotética capacidade de captura perfeita, os N95s falham em mitigar a disseminação do SARS-CoV-2.
Devemos começar vendo a transmissibilidade viral e a produção de material infeccioso como espectros, com base na gravidade da doença, na resposta imune de um determinado indivíduo e no progresso no curso da doença. Todos demonstraram ter impactos significativos na carga viral de um indivíduo infectado com SARS-CoV-2. Discutiremos números de produção versus taxas de infectividade e métodos de medição para dose infecciosa mínima.
Esses são fatores importantes a serem considerados na mitigação patogênica, mesmo de forma independente, mas combinados, eles podem nos mostrar especificamente se uma determinada abordagem terá um resultado desejado na eliminação de um risco infeccioso. Os números de saída de emissões respiratórias demonstram quanta matéria está sendo expelida por um indivíduo e se são ou não transmissíveis com um patógeno respiratório, mas os números de saída variam muito entre estágios mais graves no início da doença, períodos de recuperação e quando PCR-negativo para um dado patógeno.
Ao comparar a produção com as proporções de unidade formadora de partícula para placa (PFU), temos uma taxa de quantas partículas emitidas são vírions viáveis capazes de causar infecção. Cada uma dessas unidades infecciosas é chamada de PFU. O número de PFUs necessário para ser recebido por um hospedeiro potencial é dado como um valor de dose infecciosa mínima (MID), que é um limite que, uma vez atingido, o início da infecção deve ser antecipado.
Observando os números da proporção de partícula para PFU e calculando o potencial MID, o produto final é o número potencial de indivíduos que podem ser infectados em um determinado período de tempo.
Com esse limite MID para o potencial de infecciosidade, podemos então aplicar a capacidade de captura perfeita hipotética de um determinado aparelho para ver se o melhor cenário resulta na probabilidade de o aparelho mitigar ou impedir que o limite MID seja atingido para o perigo.
Aqui, examinamos a saída, a proporção de partícula para PFU e MID para SARS-CoV-2, versus a hipotética capacidade de captura perfeita para N95s, para demonstrar que mesmo com uma taxa perfeita de captura (e neste caso, de matéria muito menor do que o aparelho é aprovado ou projetado para capturar), os 5% nunca capturados ainda é uma exposição potencial abundante o suficiente a matéria infecciosa para resultar em infecção.
Faixas de partículas e comportamento correspondente da matéria emitida
As medidas de mitigação da pandemia deveriam ter começado com o tamanho mínimo de partícula viável, que para SARS-CoV-2 cai para 0.06-0.14 µm. Embora frequentemente pressionado por autoridades de saúde pública, os N95s são exclusivamente classificados e aprovados para capturar matéria maior que 0.3 µm. Mais de 90% por cento das partículas exaladas caíram para 0.3 µm. Esse tamanho de matéria permanece no ar por longos períodos - horas, até dias, dependendo das taxas de troca de ar dentro do espaço determinado. Demonstrou-se que o SARS-CoV-2 permanece viável após horas como um aerossol fora de um hospedeiro e por dias em superfícies.
"O SARS-CoV-2 vírus foi observado viável por 3 horas. em aerossóis, com diminuição da concentração do vírus infeccioso de 103.5 para 102.7 TCID50 por litro de ar”.
Este estudo usou aerossóis gerados em laboratório contendo SARS-CoV-2 infeccioso e observou a viabilidade da matéria emitida em diferentes superfícies e como aerossóis ao longo do tempo.
Ao considerar o seguinte, também se pergunta se a máscara porosa e as membranas do respirador desempenharam um papel no aumento do prazo de viabilidade da matéria viral:
"Os tempos de sobrevivência de vírus transmitidos pelo ar em superfícies diferir com base em se as superfícies são não porosas (por exemplo, plástico, aço inoxidável, vidro) ou porosas (por exemplo, papéis e roupas). As superfícies não porosas são os principais contribuintes para a transmissão de doenças, uma vez que os tempos de sobrevivência dos vírus transmitidos pelo ar são muito mais longos do que os das superfícies porosas”.
Máscaras e respiradores certamente contam como superfícies porosas. Muitos respiradores também são construídos com plástico fundido. A viabilidade viral nas membranas das máscaras foi suficientemente estudada?
As taxas de viabilidade do aerossol são importantes porque demonstram a capacidade de transmissão em espaços fechados sem a presença de um indivíduo transmissível. Com o um indivíduo transmissível presente e emitindo no espaço determinado, a saída seria uma constante e a matéria viral viável aumentaria a saturação atmosférica do patógeno em cada respiração.
Um problema negligenciado, mas crítico, com máscaras e respiradores é a vedação - pequenas áreas de folga tornam esses aparelhos ineficazes para o usuário. Raramente, ou nunca, alguém usa esses aparelhos corretamente, sob os termos de uso necessários, então nos deparamos com aparelhos já não atenuantes sendo usados incorretamente.
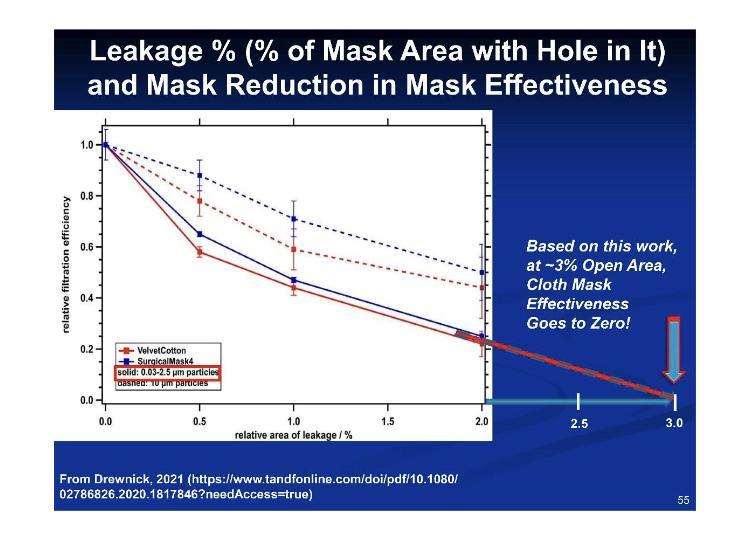
De acordo com esses números para ajuste versus vazamento, 3.2% de vazamento equivale a 100% de ineficácia.
Todos esses são fatores que devem ser considerados ao abordar a causa de um aparelho que não consegue mitigar um determinado perigo. Examinando a seguir a produção de emissões, Dose Infecciosa Mínima, Unidades Formadoras de Placas e como elas se relacionam, podemos entender melhor por que os controles de engenharia sempre foram a resposta correta, e não a implementação em massa de aparelhos de proteção respiratória.
Emissões respiratórias de pacientes “doentes” - PCR-positivo versus resultados negativos do teste:
Na pesquisa sobre a produção de aerossóis em indivíduos saudáveis versus SARS-CoV-2 PCR-positivos, 90%+ por cento das partículas emitidas por indivíduos PCR-positivos estavam abaixo de 0.3 µm, e as contagens de matéria emitida foram realizadas comparando indivíduos com diferentes gravidades de doença com indivíduos PCR-negativos.
"O mediano exalou a contagem de partículas foi significativamente elevada em pacientes positivos para PCR de SARS-CoV-2 (1490.5/L [46.0–34,772.0/L]) em comparação com controles saudáveis (252.0/L [0.0–882.0/L]; p < 0.0001.”
Se usarmos uma taxa de emissão respiratória de 4.3-29 litros por minuto (do EPA Exposure Factors Handbook), a faixa positiva de PCR de maior saída de 34,772 partículas por litro multiplicada por 29 litros por minuto é tão alta quanto 1,008,388 partículas emitidas por minuto .
Embora eu não esteja afirmando que todas essas partículas eram partículas de vírus individuais, ou partículas de vírus viáveis, há, no entanto, uma diferença altamente significativa na matéria emitida por indivíduos positivos e negativos para PCR (valores médios de 1,490.5 vs 252). Uma proporção para converter partículas em PFUs será apresentada após a discussão do papel das PFUs.
Tamanhos de partícula e taxas de emissão:
O estudo discutiu anteriormente as faixas de tamanho de partículas emitidas por medidas em indivíduos positivos e negativos para SARS-CoV-2.
"Em relação à partícula distribuição de tamanho, os canais de tamanho disponíveis (no total, 14 canais de tamanho de 0.15 a 5.0 μm) foram analisados em três bandas de tamanho: <0.3 μm, 0.3–0.5 μm e >0.5–5.0 μm. Para ambos os grupos, a maioria dos aerossóis (>90% no grupo SARS-CoV-2 PCR-positivo e>78% no grupo -negativo) foram encontrados no menor intervalo (<0.3 μm). Especialmente para o grupo COVID-positivo, os aumentos na concentração total de aerossol foram dominados por aumentos de partículas ≤0.3 μm.”
Dez indivíduos dos 64 pacientes hospitalizados amostrados, que estavam entre os casos mais graves, foram responsáveis por cerca de 64.8% por cento das contagens de partículas exaladas, por isso é importante neste caso olhar para mínimo faixa de saída conservadora e o potencial de infecciosidade ao executar cálculos de saída e dose infecciosa mínima. Especificamente, o jornal afirmava:
"No SARS-CoV-2 No grupo PCR-positivo, 15.6% (n = 10/64) apresentaram altas contagens e foram responsáveis por 64.8% de todas as contagens de partículas exaladas no grupo. Além disso, o 15.6%, equivalente a 3.5% de todos os pacientes (n = 10/288), foi responsável por 51.2% de todas as partículas exaladas.”
Se compararmos aqueles que apresentam a maior gravidade da doença com as taxas de infecciosidade, podemos entender mais sobre a produção de partículas viáveis por indivíduos transmissíveis. Considerando a baixa produção de matéria emitida e vírions por PCR-negativo e recuperando PCR-positivo, pode ser seguro especular que isso fala da baixa probabilidade de transmissão assintomática ser um fator principal na disseminação viral.
A presença de cópias de RNA versus concentrações de vírions viáveis
Nem todas as cópias de RNA ou partículas virais são capazes de formar PFUs resultando em replicação viral. Embora tenham sido fornecidos dados sobre quantas unidades infecciosas são geradas, isso é não a taxa de saída de emissões. Estas são estimativas da produção viral total durante uma infecção.
"Dividindo por estimativas para o inverso da taxa de depuração viral dá uma produção total estimada de 3 × 109 para 3 × 1012 virions, ou 3 × 105 para 3 × 108 unidades infecciosas durante o curso completo de uma infecção característica”.
Simplificado, ou seja, uma produção total de 3 bilhões a 3 trilhões de partículas virais, ou 300,000 a 300 milhões de unidades infecciosas geradas ao longo da doença.
saída de vírus
Existem diferentes métodos de estabelecer a saída do virion, que oferecem intervalos ligeiramente diferentes quando vistos lado a lado. Alguns estudos mostram o total de vírions emitidos, como os seguintes:
"Alguns pacientes têm títulos virais que excedem o título médio de Wölfel et al em mais de duas ordens de magnitude, aumentando assim o número de virions nas gotículas emitidas para mais de 100,000 por minuto de fala.”
Outros estudos fornecem contagens totais de partículas e contam com o uso de fatores de conversão da saída total para virions viáveis. O que é importante estabelecer é que a produção geral de partículas virais não é igual ao total de vírions viáveis, ou seja, vírions capazes de criar Unidades Formadoras de Placas (PFU).
PFUs – Compreendendo as partículas virais necessárias para formar Unidades Formadoras de Placas (PFU) individuais:
Embora todo o RNA viral e as partículas virais emitidas não sejam capazes de replicação viral e criação de PFUs, entende-se que cada PFU é criado por uma partícula viral viável. Os trechos a seguir discutem o impacto das PFUs nas infecções virais e no início.
"O ensaio é projetado de modo que cada placa resulta da infecção pela multiplicação de uma única partícula viral infecciosa. Como tal, PFU/ml é considerado uma medida do número de unidades infecciosas por mililitro (UI/ml), com a ressalva de que não se pode ter certeza de uma proporção de um para um de placas para partículas infecciosas na alíquota aplicada. ”
"Para a maioria dos vírus animais, uma partícula infecciosa é suficiente para iniciar a infecção.”
"A natureza linear da curva dose-resposta indica que um único virion é capaz de iniciar uma infecção. No entanto, a alta proporção partícula-pfu de muitos vírus mostra que nem todos os vírions são bem-sucedidos. Uma alta proporção partícula-pfu às vezes é causada pela presença de partículas não infecciosas com genomas que abrigam mutações letais ou que foram danificadas durante o crescimento ou purificação”.
"Geralmente é assumido que uma placa é o resultado da infecção da célula por um único virion. Se for esse o caso, todos os vírus produzidos a partir do vírus na placa devem ser um clone, ou seja, devem ser geneticamente idênticos”.

Para resumir, uma partícula viral viável, ou virion, é capaz de criar uma PFU, na qual essa partícula viral se replica. Parte da matéria criada é apenas RNA viral incapaz de causar infecção independentemente, e parte da matéria criada é capaz de replicação e infecção.
O relacionamento entre a saída total de partículas e a criação de PFUs é chamada de partícula para proporção de PFU. Para SARS-CoV-2, a proporção de partículas emitidas para PFUs é de 1000 a 1,000,000.
Estudos de PFU e Dose Mínima Infecciosa
Nossa taxa de respiração varia dependendo da idade e do nível de atividade. A frequência respiratória humana média é de 16 a 20 respirações por minuto. Para os propósitos desta discussão, uma taxa de respiração de 4.3-29 litros por minuto (do EPA Exposure Factors Handbook) será usada. Esta referência dá um alcance de até 53 litros por minuto. Analisaremos a saída como vírions por minuto e a dose infecciosa mínima como PFUs e vírions para transmissão, pois ambos são explorados na pesquisa disponível.
Dados de Dose Infecciosa Mínima (MID) da Literatura:
Estudos de comparação de diferentes vírus respiratórios e estudos em animais SARS-CoV-2 foram usados para contribuir com muitas estimativas de MID, mas este artigo se concentra apenas em estudos humanos, tanto quanto possível.
"Embora o MID de SARS-CoV-2 em humanos precisa de mais pesquisas, espera-se que sejam aproximadamente 100 partículas virais. O único estudo humano sobre um coronavírus foi relatado para HCoV-229E e seu MID é 9 PFU. Além disso, se a transmissão por aerossol for o modo dominante, o MID será menor.”
"Na verdade, infecções por aerossol requerem menos doses, por exemplo, ~ 100 vezes menos do que infecções baseadas em gotículas.”
"A dose infecciosa mínima de SARS-CoV-2 causando COVID-19 em humanos em estudos transversais e de séries de casos avaliados foi baixo; em um estudo de série de casos que investigou a dose infecciosa em 273 amostras de 15 pacientes positivos para SARS-CoV-2, a dose infecciosa mínima detectada foi de 1.26 PFU in vitro no ensaio COVID-19-RdRp/Hel.1 Em outro estudo, 248 amostras oro-nasofaríngeas de indivíduos com COVID-19 foram avaliadas e a dose infecciosa foi relatada como 364 PFU.”
"Em um estudo de série de casos que avaliou 97 crianças de 10 anos ou menos, 78 crianças de 11 a 17 anos e 130 adultos, a dose infecciosa em crianças de 11 a 17 anos foi menor do que dois outros grupos (125 PFU). As crianças tiveram menor crescimento do vírus vivo, limiares de ciclo mais altos e menor concentração viral em comparação com os adultos, portanto, as crianças não são os principais portadores da infecção. Crianças com idade ⩽10 anos eram mais propensas a serem assintomáticas do que outras.”
"Um dos mais um bem discutido (sic) é o estudo feito por Basu et al., cujo objetivo principal foi avaliar o tamanho das gotículas que têm alta probabilidade de causar infecção. Mas além desse achado, eles também tiveram alguns pontos relacionados à carga viral que pode causar a infecção. Eles descobriram que o número de vírions colocados na nasofaringe de um indivíduo próximo ao longo de 2.5 h de duração aproxima-se de (11/5) vírions por minuto × 60 min × 2.5 h = 330.”
Estudos de comparação incluindo outros coronavírus mostraram que as PFUs podem ser bastante baixas para vírus respiratórios.
"Infecciosidade estimada de O SARS-CoV-1 era comparável a outros coronavírus, incluindo o HCoV-229E, um agente causador de um resfriado leve em humanos. ID10 e ID50 de SARS-CoV-1 foram relatados como 43 e 280 PFU (400 TCID50) em um estudo experimental.”
"a identidade humana50 para o subtipo sazonal de coronavírus 229E que causa resfriado comum leve em humanos foi relatado como 13 TCID50. "
Os números discutidos nos estudos fornecidos sobre SARS-CoV-2 foram 1.26, 100, 125, 330 e 363 PFU para transmissão, falando novamente para um amplo espectro de suscetibilidade.
Saída de vírions viáveis versus potencial de limite de Dose Infecciosa Mínima
Usando esses números disponíveis, podemos abordar a afirmação de que os N95s fornecem valor protetor significativo contra aerossóis infecciosos, observando as contribuições de saída, potencial de infectividade da matéria viral emitida, intervalos de PFU, então podemos pesar esses intervalos contra uma hipotética capacidade de captura perfeita de N95s capturando 95% por cento da matéria, contra os restantes 5% não capturados. Novamente, observe que os N95s não são projetados nem aprovados para capturar <0.3 µm, e estamos discutindo um patógeno que tem um tamanho mínimo de partícula viável de 0.06-0.14 µm.
Emissões respiratórias de um indivíduo transmissível atingiu mais de 100,000 vírions em um minuto, embora nem todos os vírions emitidos possam ser considerados infecciosos. Documentos de pesquisa adicionais reivindicaram uma produção de até 750,000 vírions/minuto (mas faltam dados que comprovem tais afirmações). Também deve ser notado que obviamente não inalamos todo o material expirado de um indivíduo, mas nossa proximidade com um indivíduo transmissível, sua taxa de saída, duração dentro do espaço e a ventilação dentro desse determinado espaço são fatores que terão um impacto na probabilidade de transmissão que não pode ser expresso de forma linear ou previsível.
No estudo exploramos acima, a faixa positiva de PCR de saída mais alta foi de 34,772 partículas por litro, com aquelas que emitiam as faixas mais altas de saída compondo 64% por cento da matéria total emitida.
Primeiro, vamos criar uma saída horária de cada uma dessas faixas e, em seguida, aplique a proporção de partículas para PFU para cada faixa de 1,000 a 1,000,000.
Faixa de saída A
Uma hora de um indivíduo transmissível em um espaço fechado emitindo 100,000 virions por minuto seria uma saída de 6 milhões de virions (100,000 × 60 minutos). Um período de 8 horas em um espaço fechado equivale a 48 milhões de vírions emitidos (100,000 × 480 minutos). Com a proporção de partículas para PFU de 1,000 a 1,000,000, isso nos dá 6,000 vírions viáveis em uma hora, 48,000 em 8 horas.
Os números de PFU dos estudos discutidos fornecidos foram 1.26, 100, 125, 330 e 363 PFU necessários como dose infecciosa mínima. Dividi cada quantidade de vírions viáveis por cada número de PFU para obter cada potencial para o limite MID listado.
Faixa de saída B
No estudo de coleta de partículas positivas por PCR, 34,772 partículas por litro foi a faixa mais alta coletada, com ~ 64% por cento do total de partículas emitidas e contadas provenientes de 10 fontes que estavam entre as mais afetadas adversamente por sua infecção por SARS-CoV-2 . Se olharmos para 34,772 partículas multiplicadas por um volume de emissão de 29 litros por minuto, a faixa de saída chega a 1,008,388 partículas emitidas por minuto.
O EPA Exposure Handbook lista uma faixa por minuto de até 53 litros por minuto, portanto, usar uma figura de 29 litros por minuto não é a maior faixa de saída possível. As faixas de saída de 7 e 29 litros por minuto serão usadas porque são faixas de saída caindo em faixas de nível de atividade sedentária a moderada.
A 29 litros por minuto, multiplicado por 34,772 partículas por litro (1,008,388 partículas), para uma produção de 60 minutos, o produto é 60,503,280 (1,008,388×60) partículas por hora e 484,026,240 por período de 8 horas (1,008,388×480). minutos).
Com uma proporção de partícula para PFU de 1,000 a 1,000,000 para COVID, isso nos dá 60,503 vírions viáveis emitidos por hora e 484,026 vírions viáveis por período de 8 horas.
Esses cálculos nos fornecem o potencial de saída de um indivíduo transmissível em termos não apenas de quantas partículas de vírus são emitidas, mas também do potencial de atingir o limite MID para infectar um determinado número de pessoas com base no número de PFU usado.
Embora a gama de PFU demonstrada para SARS-CoV-2 seja bastante ampla, devemos antecipar um espectro de transmissibilidade com base no estado de saúde individual e na resposta imune. Embora 1.26 PFU pareça bastante baixo, o PFU para SARS-Cov-1 demonstrou ser tão baixo quanto 13 PFU para atingir o limite MID para o início da infecção.
Mesmo se for usada uma saída de emissões mais baixa de 7 litros por minuto, isso dá uma taxa de 243,404 partículas por minuto (34,772 x 7)), 14,694,240 partículas por hora (234,404 x 60) e 116,833,920 (243,404 x 480) partículas por 8 - período de horas. Com a proporção de partícula para PFU de 1,000 a 1,000,000 aplicada, um período de 1 hora é uma saída de 14,604 virions viáveis e 116,833 em um período de 8 horas.

Com essas faixas de saída de intensidade sedentária a moderada, muitas vezes o limite MID é atingido para todos os valores de PFU estabelecidos.
Por que os N95s falharam/estão falhando/irão falhar
Os respiradores com classificação N95 são projetados e aprovados para capturar 95% por cento de matéria não baseada em óleo maior que 0.3 µm. O SARS-CoV-2 tem um tamanho mínimo de partícula viável de 0.06-0.14 µm, bem abaixo do limite de 0.3 µm, mesmo se ligado a matéria maior, portanto, esta é uma hipótese de capacidade de captura perfeita para uma faixa de partículas que esses aparelhos não foram projetados ou aprovados para captura, nem seus dados de aplicação mostraram que eles têm um desempenho de 95% ou próximo.
Para fins de exercício de capacidade hipotética de captura perfeita, concederemos a eles uma taxa de captura perfeita de 95%. Se aplicarmos 5% dos valores MID demonstrados nas faixas de saída A e B, isso demonstrará a infecciosidade de vírions viáveis versus os 5% nunca capturados (por exemplo, sem vazamento) se uma taxa hipotética de 95% perfeita de captura é atendida.
Faixa de saída A
Faixa de saída B
29 litros por minuto
7 litros por minuto
Se assumirmos uma capacidade de captura hipotética perfeita para N95s de faixas de tamanho de partícula de matéria que esses aparelhos não foram projetados ou aprovados para capturar e aplicar os 5% restantes nunca capturados, a grande maioria das faixas de saída versus PFU necessárias para atender a MID O limiar ainda permite uma exposição muitas vezes superior ao limiar MID para infecção potencial de muitos indivíduos em períodos de 1 hora e 8 horas para cada intervalo estabelecido de produção.
Resumo
Ficamos negligentes com nossos padrões de mitigação durante o surto de SARS-CoV-2 porque esse patógeno não é fatal para a esmagadora maioria das pessoas, com uma taxa de sobrevivência em torno de 99.8%. Essa leviandade em relação a uma resposta específica ao perigo é incrivelmente perigosa quando aplicada a patógenos e elementos de exposição mais mortais.
Ao examinar o melhor cenário hipotético, podemos prever melhor se uma determinada medida terá um impacto atenuante no perigo identificado. Para N95s versus saída, proporções de partícula para PFU e MID para SARS-CoV-2, o melhor cenário de captura perfeita hipotética de matéria que esses aparelhos não foram projetados nem aprovados para capturar mostra que eles ainda não são atenuantes para este perigo, e as recomendações para seu uso devem ser imediatamente reconsideradas.
Recursos adicionais:
Discute a carga viral média das amostras: https://www.nature.com/articles/s41586-020-2196-x.
Dose Infecciosa Mínima
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7090536/ (no MID em geral, não específico do SARS-CoV-2).
Glossário
aerossol - partículas dispersas no ar ou gás, definidas como menores que 5 mícrons de tamanho.
assintomática (disseminação) – o conceito teórico de transmitir um patógeno a outros sem exibir nenhum sintoma estabelecido do referido patógeno.
saturação atmosférica - a quantidade de matéria viável que permanece no alto dentro de um espaço fechado.
emissões – matéria respiratória exalada.
regime de fluxo laminar - partículas fluidas seguindo caminhos suaves em camadas.
dose infecciosa mínima - a quantidade mínima de um perigo a que alguém deve estar exposto para que o início da doença seja antecipado.
N95 - um respirador de filtragem de partículas sem captura de óleo capaz de bloquear até 95% da matéria acima de 0.3 µm.
início - o início de uma doença ocorrendo assim que o limite mínimo de dose infecciosa é atingido.
resultado - as emissões sendo lançadas em um determinado ambiente por um indivíduo transmissível.
saída como uma constante - um indivíduo dentro de um espaço fechado emitindo aerossóis respiratórios carregados de partículas infecciosas na atmosfera dada, saturando a atmosfera dada mais com matéria infecciosa a cada respiração.
proporção de partícula para PFU - uma razão para cálculos de produção patogênica que pesa o número total de partículas emitidas contra as partículas que são viavelmente infecciosas.
PCR-negativo - um determinado sujeito de teste não recebe um resultado de teste positivo quando testado com metodologia de PCR para um determinado patógeno. PCR significa usar a técnica de reação em cadeia da polimerase.
PCR-positivo - um determinado sujeito de teste recebe um teste positivo quando testado usando a técnica de reação em cadeia da polimerase para um determinado patógeno.
capacidade de captura perfeita - captura de matéria perigosa em uma porcentagem de eficácia combinada dada por um produto como sua melhor taxa hipotética possível.
Unidades Formadoras de Placas (PFUs) – a criação de PFUs requer que um virion infecte uma célula hospedeira, onde a replicação viral começa. Um limite de um determinado número de PFUs é necessário para o início da doença, conhecido como dose infecciosa mínima.
cópias de RNA - material genético necessário para fazer cópias de proteínas dentro de uma célula. As cópias de RNA não equivalem a vírions viáveis capazes de replicação.
TCID50 – uma abreviação para dose infecciosa de cultura de tecidos, que é a diluição de um vírus necessária para infectar 50% das células em um ensaio de cultura.
carga viral - a quantidade de partículas virais em uma determinada substância, emissão ou dentro do corpo de um indivíduo transmissível.
viabilidade viral - virions capazes de infectar uma célula e criar unidades formadoras de placas (PFUs).
virion ou virion viável uma partícula completa de vírus infeccioso.
Publicado sob um Licença Internacional Creative Commons Attribution 4.0
Para reimpressões, defina o link canônico de volta ao original Instituto Brownstone Artigo e Autor.









