O Telegraph relatou recentemente que o público foi instruído a parar de tomar remédios para tosse e resfriado por medo de segurança em relação à droga folcodina, um supressor de tosse opióide.
Vinte dos medicamentos comuns para tosse e resfriado, incluindo as cápsulas Day e Night Nurse, foram retirados do mercado com urgência por ordem dos reguladores de medicamentos devido a preocupações sobre um risco “muito raro” de anafilaxia, um evento adverso com risco de vida.
O anúncio de 'Recall de Medicamentos de Classe 2' retirado do relatório do governo do Reino Unido site do Network Development Group, é mostrado abaixo.

Quando se trata das vacinas de mRNA COVID-19, os padrões regulatórios duplos nunca foram tão óbvios.
A anafilaxia foi identificada como um risco importante pela Agência Europeia de Medicamentos, já em dezembro de 2020, no CHMP (Comitê de Medicamentos para Uso Humano) da EMA. relatório de avaliação na vacina Pfizer-BioNTech COVID-19, vista abaixo.
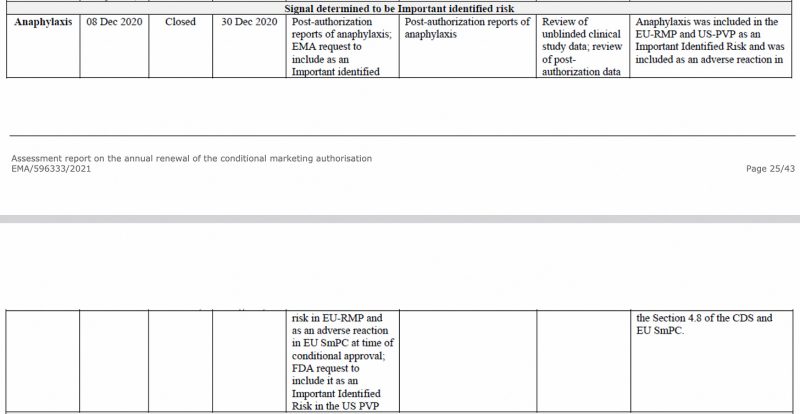
Além disso, na primeira Atualização Periódica de Segurança da UE Report , que eu já analisado, a anafilaxia foi novamente sinalizada como um importante risco identificado.

Neste relatório de farmacovigilância, foram identificados 3,827 casos relevantes (indivíduos), a partir dos dados pós-autorização. O país com maior incidência foi o Japão, seguido pelos Estados Unidos e Reino Unido.
O maior número de casos notificados foi entre as mulheres, chocantes 3,182 casos em comparação com 454 casos para homens, com idade média de 44 anos. O fato de que 7 vezes mais casos foram relatados para mulheres não é novidade. Em dezembro de 2021, eu analisado a Pfizer preparou documento para o FDA, cobrindo o período de 3 meses, de dezembro de 2020 a 28 de fevereiro de 2021 - no caso de anafilaxia - as mulheres foram 8 vezes mais afetadas.
Assim, 98% dos eventos adversos relevantes (incluindo reação anafilática, choque anafilático, reação anafilactóide e choque anafilactóide) foram classificados como graves!
Além disso, para 92 por cento dos eventos, o tempo decorrido para um evento adverso ocorrer após a administração da vacina foi inferior a 24 horas.

Resultados fatais
Dos 3,922 eventos, 28 foram fatais e, para impressionantes 704, o resultado era desconhecido. Nenhum número de casos foi dado para resultados fatais.

Casos por faixa etária
Dos 3,827 casos relevantes (indivíduos), 23 eram da faixa etária pediátrica e 3,021 da faixa etária adulta.
Presença de comorbidades
O que é digno de nota é que cerca de 2/3 de todos os casos de anafilaxia não tem alguma comorbidade (problemas de saúde subjacentes).

Dado o que aconteceu desde que as vacinas mRNA COVID-19 foram lançadas, não é surpresa ler: “nenhuma nova informação de segurança foi identificada referente ao risco de anafilaxia com BNT162b2” (vacina Pfizer-BioNTech COVID-19). A razão dada (ou a desculpa por trás da qual se escondem) é que 'esse risco é comunicado. em caso de um evento anafilático raro após a administração da vacina.”
Debaixo Regulamento 174, Informações para profissionais de saúde do Reino Unido, que foi revisado pela última vez em dezembro de 2021, afirma-se o seguinte:

na verdade, no próprio primeiro dia do lançamento da vacina Pfizer-BioNTech COVID-19 no Reino Unido, houve dois relatos de anafilaxia e um caso relatado de uma possível reação alérgica. Isso não impediu a MHRA de recolher o produto - eles simplesmente contornaram o problema afirmando que pessoas com histórico de alergias não deveriam tomar a vacina.
Mesmo quando eles sabiam, os ingredientes de nanopartículas lipídicas da Pfizer/BioNTech ALC-0159 e ALC-0315 nunca foram incluídos em nenhum medicamento licenciado antes. ALC-0159 contém PEG (Polietilenoglicol) que é conhecido por causar anafilaxia.
É inequívoco: a anafilaxia era um evento adverso com risco de vida conhecido, mais ou menos na mesma época em que a autorização de uso de emergência foi concedida para a vacina Pfizer-BioNTech COVID-19. No entanto, por ser uma “vacina injetável”, de alguma forma obteve um passe livre de todos os reguladores de medicamentos, não importa quantos dados contundentes se acumulem, quando um xarope ou cápsula para tosse, por outro lado, é recolhido com urgência com base em um “um risco muito raro de anafilaxia.”
Reeditado do autor Recipiente
Publicado sob um Licença Internacional Creative Commons Attribution 4.0
Para reimpressões, defina o link canônico de volta ao original Instituto Brownstone Artigo e Autor.









