Durante a pandemia de Covid, o governo dos EUA gastou milhares de milhões de dólares em quase 400 produtos destinados a proteger, diagnosticar e tratar centenas de milhões de pessoas – todos com o rótulo “EUA” ou “Autorização de Utilização Emergencial”.
Mas o que realmente significa EUA?
Mesmo antes de respondermos a essa pergunta, e para compreender a posição da EUA em relação a outras vias de autorização ou aprovação de produtos médicos, é útil analisar o que os EUA não são:
EUA não é uma designação para um produto experimental submetido a um ensaio clínico
Se entendermos apenas uma coisa sobre os EUA, deveria ser o seguinte: os EUA não se aplicam a um produto submetido a um ensaio clínico regido pelos regulamentos da FDA ou outros requisitos legais.
EUA também não é o mesmo que Uso de Acesso Expandido (EAU), muitas vezes chamado de acesso de “uso compassivo”, que se aplica à concessão de pacientes com doenças graves e incuráveis acesso a produtos experimentais antes de serem totalmente aprovados.
Esta tabela de um Apresentação FDA-CDC 2020 resume as diferenças entre produtos submetidos a ensaios clínicos, produtos fornecidos aos pacientes através de acesso “compassivo” expandido e produtos autorizados através dos EUA:
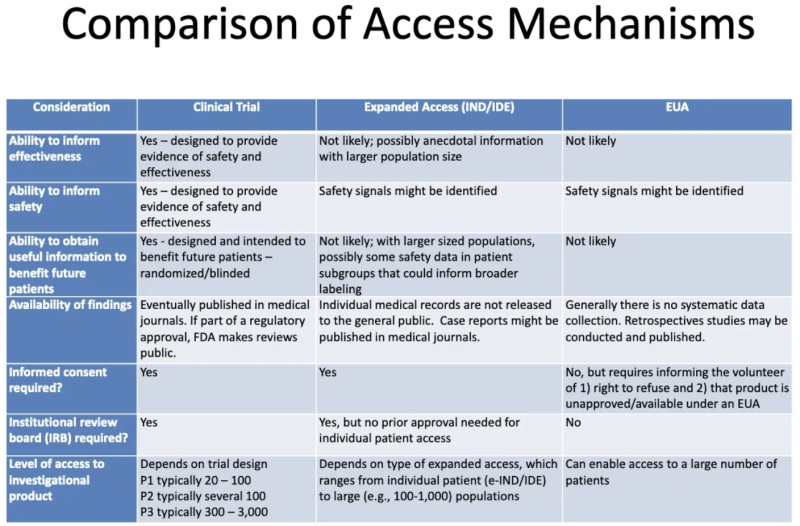
Aqui está o que esta tabela nos diz sobre os EUA:
- O processo de concessão de EUA provavelmente não gerará qualquer informação sobre a eficácia de um produto.
- O processo de concessão de AUE não foi concebido para fornecer provas de segurança ou eficácia, mas podem ser identificados sinais de segurança.
- É improvável, uma vez concedida a AUE a um produto e administrado a alguns pacientes, que qualquer informação útil seja obtida para beneficiar futuros pacientes.
- Não há recolha sistemática de dados sobre eficácia ou segurança com EUA, e nenhum dado é publicado em revistas médicas como parte do processo de aprovação regulamentar.
- Não é necessário consentimento informado, mas os pacientes que se “voluntariam” para tomar o produto devem ser informados de que podem recusar e que o produto não está aprovado/disponível sob EUA.
- Nenhum conselho de revisão institucional (IRB) é necessário. [IRB é um conselho que supostamente protege o bem-estar de seres humanos em ensaios clínicos]
Para esclarecer ainda mais até que ponto a EUA está separada de qualquer processo normal de aprovação, de uma forma Publicação do Instituto de Medicina das Academias Nacionais de 2009, encontramos esta afirmação:
É importante reconhecer que uma EUA não faz parte do caminho do desenvolvimento; é uma entidade totalmente separada, usada apenas em situações de emergência e não faz parte do processo de aprovação de medicamentos. (pág. 28)
Para resumir:
É improvável que o processo de concessão de uma EUA de produto gere qualquer evidência de segurança ou eficácia. Depois que um produto recebe AUE e é administrado aos pacientes, é improvável que qualquer informação útil seja obtida para beneficiar futuros pacientes, porque não há coleta sistemática de dados sobre eficácia ou segurança.
Com base em todas estas informações muito claras do CDC/FDA e da IMNA, seria justo concluir que a Autorização de Uso Emergencial é um processo que deve ser aplicado de forma muito criteriosa e apenas em casos de emergências graves.
Agora vamos ver quais tipos de situações de emergência os EUA foram legalmente projetados para resolver.
EAU destina-se a emergências de ADM
As leis que permitem o “Mecanismo de Acesso” dos EUA descrito acima foram elaboradas para casos de emergências extremas e imediatas envolvendo armas de destruição em massa (ADM), também conhecidas como agentes QBRN (químicos, biológicos, radiológicos, nucleares).
Veja como a Food & Drug Administration (FDA) descreve seus poderes EUA:
Seção 564 da Lei FD&C (21 USC 360bbb – 3) permite que a FDA fortaleça as proteções de saúde pública contra agentes biológicos, químicos, nucleares e radiológicos.
Com esta autoridade dos EUA, a FDA pode ajudar a garantir que contramedidas médicas possam ser usadas em emergências para diagnosticar, tratar ou prevenir doenças ou condições graves ou potencialmente fatais causadas por agentes biológicos, químicos, nucleares ou radiológicos quando não houver e alternativas disponíveis (entre outros critérios).
Estes poderes da EUA foram concedidos em 2004 em circunstâncias muito específicas relacionadas com a preparação para ataques por agentes QBRN.
Como explicado no Projeto de Lei de Saúde de Harvard Law,
Em última análise, foi a Guerra ao Terror que daria origem à autorização de uso emergencial. Após os eventos de 11 de setembro de 2001 e os subsequentes ataques com antraz pelo correio, o Congresso promulgou a Lei do Projeto Bioshield de 2004.
A registro indica que o Congresso estava focado especificamente na ameaça do bioterrorismo, e não na preparação para uma pandemia que ocorre naturalmente.
Dado um tipo tão restrito de situação de emergência verdadeiramente extrema envolvendo um ataque de ADM, é compreensível que o “mecanismo de acesso” dos EUA não exija muita supervisão regulamentar ou adesão a quaisquer padrões de fabrico ou de ensaios clínicos.
Então, o que o mecanismo de acesso aos EUA realmente exige?
As 3 etapas para autorização de uso emergencial (EUA)
Três coisas têm que acontecer para que a EUA seja concedida a um produto médico:
- O Secretário de Segurança Interna, o Secretário de Defesa ou o Secretário de Saúde e Serviços Humanos precisam determinar que existe uma emergência envolvendo um ataque ou uma ameaça de ataque com um agente QBRN ou uma doença causada por tal agente.
- A FDA precisa garantir que atende a quatro “critérios legais” ao emitir os EUA.
- A FDA tem que “impor certas condições exigidas” nos EUA.
EUA Passo 1: Declarar uma Emergência QBRN
A declaração de emergência para EUA é separada e não está relacionada com quaisquer outras declarações de emergência que possam ser emitidas pelo Presidente, pelo Secretário do HHS ou por qualquer outra pessoa. Deve ser emitido especificamente para fins de ativação da EUA e pode ser encerrado ou prorrogado independentemente de qualquer outra declaração de emergência.
Aqui está o que a lei dos EUA afirma são os quatro cenários possíveis para a ativação do “mecanismo de acesso” dos EUA:
- uma determinação do Secretário de Segurança Interna de que existe uma emergência doméstica, ou um potencial significativo para uma emergência doméstica, envolvendo um risco elevado de ataque com um agente ou agentes biológicos, químicos, radiológicos ou nucleares;
- uma determinação do Secretário de Defesa de que existe uma emergência militar, ou um potencial significativo para uma emergência militar, envolvendo um risco elevado para Unido Unidos forças militares, incluindo pessoal que opera sob a autoridade do Título 10 ou Título 50, de ataque com—
- um agente ou agentes biológicos, químicos, radiológicos ou nucleares; ou
- um agente ou agentes que podem causar, ou de outra forma associados a, um risco iminente e específico para a vida dos Estados Unidos Unidos forças militares;
- uma determinação do Secretária [de Saúde e Serviços Humanos] que existe uma emergência de saúde pública, ou um potencial significativo para uma emergência de saúde pública, que afecta, ou tem um potencial significativo para afectar, a segurança nacional ou a saúde e segurança de Unido Unidos cidadãos residentes no exterior e que envolva agente ou agentes biológicos, químicos, radiológicos ou nucleares, ou doença ou condição que possa ser atribuível a tal agente ou agentes; ou
- a identificação de uma ameaça material de acordo com a seção 319F-2 do Lei do Serviço de Saúde Pública [42 USC. 247d-6b] suficiente para afetar a segurança nacional ou a saúde e segurança de Unido Unidos cidadãos residentes no estrangeiro.
EUA Passo 2. Atendendo aos Critérios Estatutários
Depois que um dos secretários declara que existe uma emergência que justifica os EUA, há mais quatro “critérios legais” que devem ser atendidos para que o FDA possa emitir os EUA. Veja como o FDA explica esses requisitos:
- Doença ou condição grave ou com risco de vida
Para que a FDA emita uma EUA, o(s) agente(s) CBRN referido(s) na declaração de EUA do Secretário do HHS devem ser capazes de causar uma doença ou condição grave ou potencialmente fatal.
- Evidência de eficácia
Os produtos médicos que podem ser considerados para uma EUA são aqueles que “podem ser eficazes” para prevenir, diagnosticar ou tratar doenças ou condições graves ou potencialmente fatais que podem ser causadas por um(s) agente(s) CBRN identificado(s) na declaração de segurança do Secretário do HHS. emergência ou ameaça de emergência nos termos da seção 564 (b).
O padrão “pode ser eficaz” para EUAs prevê um nível de evidência inferior ao padrão de “eficácia” que a FDA utiliza para aprovações de produtos. A FDA pretende avaliar a eficácia potencial de um possível produto EUA caso a caso, utilizando uma análise de risco-benefício, conforme explicado abaixo.
[NEGRO ADICIONADO]
- Análise de risco-benefício
Um produto pode ser considerado para uma EUA se o Comissário determinar que os benefícios conhecidos e potenciais do produto, quando usado para diagnosticar, prevenir ou tratar a doença ou condição identificada, superam os riscos conhecidos e potenciais do produto.
Ao determinar se os benefícios conhecidos e potenciais do produto superam os riscos conhecidos e potenciais, a FDA pretende olhar na totalidade das evidências científicas para fazer uma determinação geral do risco-benefício. Tais evidências, que poderia surgir de diversas fontes, pode incluir (mas não limitado a): resultados de ensaios clínicos nacionais e estrangeiros, dados de eficácia in vivo de modelos animais e dados in vitro, disponível para consideração da FDA. O FDA também avaliará a qualidade e a quantidade do evidência disponível, dado o estado atual do conhecimento científico.
[NEGRO ADICIONADO]
- Sem alternativas
Para que a FDA emita uma EUA, não deve haver nenhuma alternativa adequada, aprovada e disponível ao produto candidato para diagnosticar, prevenir ou tratar a doença ou condição. Um produto alternativo potencial pode ser considerado “indisponível” se não houver fornecimentos suficientes da alternativa aprovada para satisfazer plenamente a necessidade de emergência.
EUA Passo 3. Imposição das Condições Exigidas
Assim que tivermos a declaração de emergência específica da EUA, e uma vez que a FDA determine que o produto pode ser eficaz e que quaisquer provas disponíveis mostrem que os seus benefícios superam os seus riscos, haverá mais uma camada de regulamentação relacionada.
Aqui está como um Relatório do Serviço de Pesquisa do Congresso de 2018 sobre EUA explica isso:
O FFDCA §564 orienta a FDA a impor certas condições exigidas em um EUA e permite condições discricionárias adicionais quando apropriado. As condições exigidas variam dependendo se a EUA é para um produto não aprovado ou para um uso não aprovado de um produto aprovado. Para um produto não aprovado, as condições de utilização devem:
(1) garantir que os profissionais de saúde que administram o produto recebam as informações necessárias;
(2) garantir que os indivíduos a quem o produto é administrado recebam as informações necessárias;
(3) prever o monitoramento e a notificação de eventos adversos associados ao produto; e
(4) prever a manutenção de registros e relatórios por parte do fabricante.
Conclusão
Conforme observado neste artigo, o FDA/CDC reconhece claramente que é improvável que o processo de concessão da Autorização de Uso de Emergência (EUA) gere qualquer informação sobre a eficácia ou segurança de um produto. Quando olhamos para a letra da lei que rege os EUA, vemos que esta é, de facto, uma avaliação correta.
A lei dos EUA não impõe quaisquer normas legais ou regulamentares que possam determinar se um produto é seguro ou eficaz. Os únicos padrões são se o FDA acredita que o produto pode ser eficaz e que seus benefícios conhecidos superam os danos conhecidos. Se não houver danos ou benefícios conhecidos, porque o produto nunca passou pelo processo de aprovação do medicamento, a FDA pode usar quaisquer informações ou padrões que escolher para fazer essa determinação.
Resulta de tudo isto que uma empresa cujo produto é candidato à EUA pode tentar demonstrar a segurança e/ou eficácia do produto através de qualquer meio que escolher. A existência de tal tentativa (seja um ensaio clínico ou outro mecanismo de coleta de dados) e a forma como essa tentativa é conduzida dependem da empresa. Nada na lei dos EUA se aplica à forma como a empresa concebe, conduz ou analisa quaisquer estudos ou outros mecanismos de recolha de dados que decida realizar.
Aplicado aos produtos Covid, isso significa:
- Não foram necessários dados de segurança ou eficácia de ensaios clínicos para que os produtos da Covid recebessem EUA.
- Quaisquer ensaios clínicos referidos no processo EUA foram conduzidos sem padrões regulatórios legalmente aplicáveis.
- Quando descobrimos que estes produtos carecem de eficácia ou segurança, não é surpresa. É um resultado altamente provável do processo.
- Não existem dados do processo EUA nos quais basear decisões não-EUA sobre segurança ou eficácia do produto. Portanto, qualquer uso do produto fora da UEA exigiria passar pelo processo de aprovação legal para produtos médicos regulares desde o início.
Mais sobre o processo de aprovação de vacinas Covid SUA PARTICIPAÇÃO FAZ A DIFERENÇA.
Reeditado do autor Recipiente
Publicado sob um Licença Internacional Creative Commons Attribution 4.0
Para reimpressões, defina o link canônico de volta ao original Instituto Brownstone Artigo e Autor.









